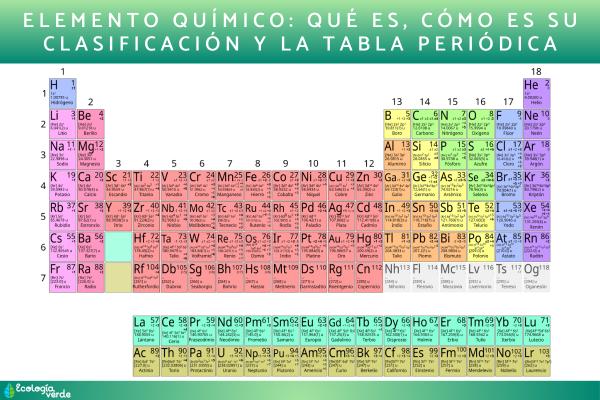
Un elemento químico es una sustancia pura compuesta solo por átomos iguales (con el mismo número de protones). De manera general, se clasifican en metales, no metales, metaloides, gases nobles y halógenos. La tabla periódica organiza los elementos según su número atómico y estructura electrónica. Se disponen en periodos (filas) y grupos (columnas), donde comparten propiedades químicas por tener igual número de electrones de valencia. Si quieres saber más sobre qué es un elemento químico, cómo es su clasificación y la tabla periódica, te invito a que sigas leyendo este artículo de EcologíaVerde.
¿Qué es un elemento químico?
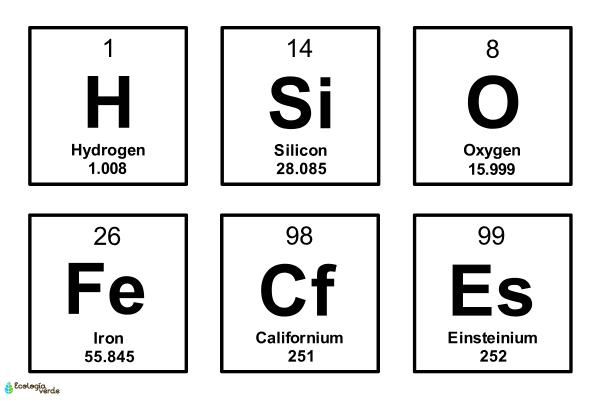
Un elemento químico se entiende como una sustancia pura compuesta únicamente por átomos iguales o del mismo tipo. A diferencia de las mezclas y compuestos, los elementos no pueden descomponerse en sustancias más sencillas mediante procesos químicos ordinarios, según lo expuesto en textos de química básica como el de Sánchez, García y Balderas[1]. Esta propiedad esencial los convierte en los componentes fundamentales de la materia. En la tabla periódica, cada elemento se identifica con un símbolo específico y se distingue por su número atómico, el cual representa la cantidad de protones presentes en el núcleo y define sus propiedades.
¿Cuántos elementos químicos hay?
El número de elementos químicos ha aumentado progresivamente. Se conocen 118 elementos químicos, de los cuales 90 son naturales y el resto sintetizados en laboratorio[2]. Los más recientes suelen ser radioactivos, con vida media breve y difícil estabilidad.
¿Cómo se clasifican los elementos químicos?
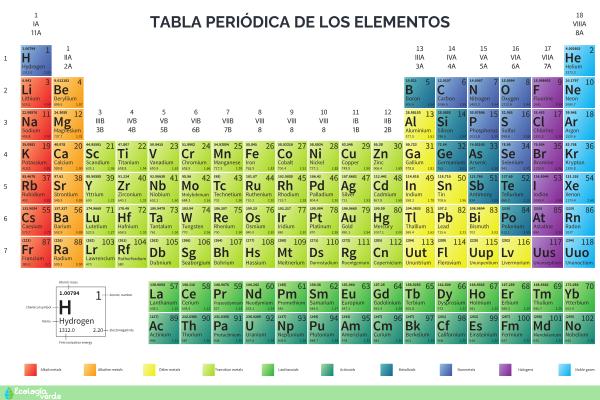
La clasificación de los elementos se basa en su ubicación en la tabla periódica y en sus propiedades fisicoquímicas. De manera general, se dividen en metales, no metales y metaloides, mientras que gases nobles y halógenos forman grupos particulares.
Metales
Los metales son la familia más amplia de la tabla periódica, ubicados a la izquierda de la línea en zigzag (excepto el hidrógeno). Se distinguen por su brillo, conductividad, maleabilidad y ductilidad, además de formar cationes fácilmente. Incluyen a los alcalinos, alcalinotérreos, de transición, lantánidos y actínidos, con gran importancia en construcción, cables, electrónica y catálisis. Por ejemplo: oro, plata, hierro, cobre, aluminio y mercurio.
No metales
Los no metales se encuentran a la derecha de la tabla periódica y se caracterizan por ser malos conductores, frágiles en estado sólido y presentarse en diversos estados físicos. Forman aniones al ganar electrones, poseen baja densidad y puntos de fusión, generan óxidos ácidos y oxiácidos, y resultan esenciales para la vida al integrar compuestos orgánicos e inorgánicos. Por ejemplo: oxígeno, nitrógeno, azufre y carbono.
Metaloides
Los metaloides, situados en la línea en zigzag de la tabla periódica, presentan propiedades intermedias entre metales y no metales. Incluyen boro, silicio, germanio, arsénico, antimonio, telurio y polonio. Son duros, frágiles, con brillo semimetálico y conductividad intermedia. Destacan como semiconductores, siendo el silicio fundamental en circuitos integrados y dispositivos electrónicos modernos. Por ejemplo: silicio, boro y arsénico.
Gases nobles
Los gases nobles, ubicados en el grupo 18, son monoatómicos, incoloros, diamagnéticos y muy poco reactivos por sus configuraciones electrónicas estables. Generalmente, no forman compuestos, aunque se han sintetizado algunos con xenón y criptón. Tienen aplicaciones relevantes: el neón se usa en anuncios luminosos y el helio, ligero y no inflamable, en globos aerostáticos. Por ejemplo: helio, neón, argón, criptón, xenón y radón.
Halógenos
Los halógenos, grupo 17 de la tabla periódica, son no metales muy reactivos cuyo nombre significa “generadores de sales”. Forman moléculas diatómicas y haluros al unirse con metales. Su reactividad disminuye con el aumento de masa atómica. Se encuentran como sales naturales y se aplican en desinfección, oxidación, fármacos y polímeros. Por ejemplo: flúor, cloro, bromo, yodo, y astato.
¿Qué es la tabla periódica y cómo organiza los elementos químicos?
La tabla periódica organiza los elementos según su número atómico y estructura electrónica. Creada por Mendeleiev en 1869 a partir de la masa atómica, permitió anticipar elementos desconocidos. En su versión moderna, los elementos se disponen en periodos (filas) y grupos (columnas), donde comparten propiedades químicas por tener igual número de electrones de valencia.
- Períodos: la tabla tiene siete periodos. En los periodos largos (4 y 5) se ubican los elementos de transición, mientras que los periodos 6 y 7 incluyen a los lantánidos y actínidos.
- Grupos: existen 18 grupos o familias. Destacan los alcalinos (1), alcalinotérreos (2), halógenos (17) y gases nobles (18). Cada periodo inicia con un metal alcalino y finaliza con un gas noble, mostrando una transición de carácter metálico a no metálico.
- Propiedades periódicas: en cada periodo varían sistemáticamente el radio atómico, la electronegatividad y la energía de ionización, aumentando el carácter no metálico.
¿Para qué sirven los elementos químicos?
- Industria y tecnología: metales como hierro, cobre y aluminio se aplican en construcción, maquinaria y cables; el cromo se usa en cromado y el vanadio en aleaciones de acero más resistentes.
- Salud y química cotidiana: halógenos como cloro y yodo son esenciales en desinfección y nutrición; oxígeno y carbono resultan vitales en respiración y bioquímica.
- Tecnología avanzada: metaloides como silicio y germanio destacan como semiconductores en circuitos, sensores y fibras ópticas.
- Gases nobles: el neón ilumina anuncios y el helio se emplea en globos y refrigeración criogénica.
- Energía y defensa: actínidos como uranio y plutonio sostienen la energía nuclear y aplicaciones militares.
¿Cuál es la diferencia entre elemento químico y compuesto químico?
La diferencia principal es que el elemento contiene un único tipo de átomo, mientras que el compuesto integra átomos distintos de diferentes elementos químicos enlazados químicamente.
Un elemento químico es una sustancia pura constituida por átomos del mismo tipo, indivisible en sustancias más simples mediante procesos químicos comunes; ejemplos son hierro, oxígeno u oro. En cambio, un compuesto químico resulta de la unión química de dos o más elementos en proporciones fijas, adquiriendo propiedades distintas a las originales; por ejemplo, agua y cloruro de sodio. Los compuestos poseen fórmula química definida y no se separan fácilmente por métodos físicos.
Si deseas leer más artículos parecidos a Elemento químico: qué es, cómo es su clasificación y la tabla periódica, te recomendamos que entres en nuestra categoría de Otros medio ambiente.
- Sánchez, J., García, M. y Balderas, Y. (2009). QUÍMICA I. https://sacaba.gob.bo/images/wsacaba/pdf/libros/quimica/LibroQuimica.pdf
- Universidad Nacional Autónoma de México. (2019). La tabla de los elementos. https://www.universum.unam.mx/assets/temp/la-tabla-de-los-elementos/la-tabla-de-los-elementos-catalogo.pdf
- Contreras, R. (2019). Tabla periódica de los elementos químicos: ciento cincuenta años de historia. Avances en Química, 14(1), 41-60. https://academiademerida.org.ve/wp-content/uploads/2019/06/RRContreras_Avances_Quimica_141-19_Periodic_Table.pdf
- Cabanne, D. y Fernández, A. (2014). CAPÍTULO II: Clasificación periódica de los elementos. https://www.fcf.unam.edu.ar/modules/uploads/2017/10/CAP%C3%8DTULO-II.pdf