Gases nobles: qué son, cuáles son, propiedades y usos

Los gases nobles son elementos del grupo 18 de la tabla periódica, conocidos por su estabilidad y baja reactividad. Incluyen helio, neón, argón, criptón, xenón y radón. Son incoloros, inodoros y gaseosos. Se usan en iluminación, soldadura, refrigeración, medicina y tecnologías avanzadas debido a sus propiedades únicas. Aprende más sobre qué son los gases nobles, cuáles son, propiedades y usos leyendo este artículo de GEOenciclopedia.
¿Qué son los gases nobles y quién los descubrió?
Los gases nobles son un grupo de elementos químicos que se caracterizan por su estabilidad excepcional. Ocupan la última columna de la tabla periódica y se distinguen por tener sus capas electrónicas completas, lo que los vuelve poco reactivos y prácticamente inertes en condiciones normales. Esta característica los convirtió durante mucho tiempo en un enigma para la química, al punto de que se creyó que no podían formar compuestos. Hoy sabemos que sí pueden hacerlo, aunque bajo condiciones muy específicas.
La historia de su descubrimiento es bastante particular porque no fueron identificados directamente en la Tierra, sino a través del estudio de la luz proveniente del Sol. En 1868, durante un eclipse solar, los astrónomos Pierre Janssen y Joseph Norman Lockyer detectaron líneas espectrales que no correspondían a ningún elemento conocido y las atribuyeron a un elemento nuevo: el helio. Recién en 1895, William Ramsay logró aislarlo en la Tierra. Ramsay y Lord Rayleigh también descubrieron el argón, el neón, el criptón y el xenón en los años siguientes. Por este trabajo, Ramsay recibió el Premio Nobel de Química en 1904. El radón fue identificado más tarde por Ernest Rutherford y Robert Owens como producto de la desintegración radiactiva del radio.
Desde entonces, estos elementos pasaron a ocupar un lugar distintivo como los gases nobles de la tabla periódica, fundamentales para comprender tanto la estructura atómica como las propiedades de la materia.
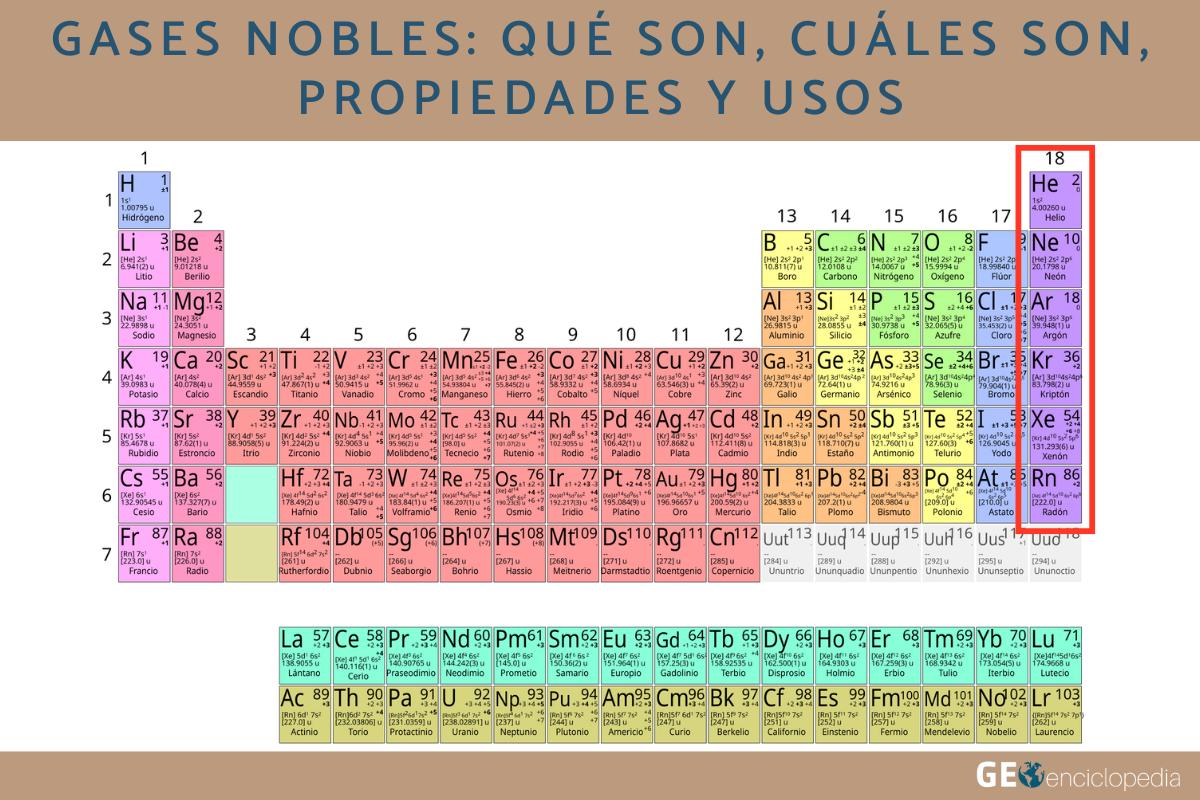
¿Cuáles son los gases nobles?
Los gases nobles conocidos y presentes en la tabla periódica son seis:
- Helio (He)
- Neón (Ne)
- Argón (Ar)
- Criptón (Kr)
- Xenón (Xe)
- Radón (Rn)
En años recientes, algunos científicos consideran la existencia del oganesón (Og) como parte del grupo, ya que se ubica en el mismo grupo 18. Sin embargo, su comportamiento químico es todavía objeto de estudio y no se lo suele incluir entre los gases nobles clásicos porque sus propiedades podrían desviarse de las del resto, debido a efectos relativistas en su estructura electrónica.

¿Cuáles son las propiedades físicas y químicas de los gases nobles?
Los gases nobles comparten un conjunto de características que explican tanto su comportamiento estable como sus usos en ciencia e industria. Entre sus propiedades se destacan:
Propiedades físicas
- Son incoloros, inodoros e insípidos en condiciones normales.
- Presentan bajos puntos de fusión y ebullición, lo que explica que se encuentren en estado gaseoso a temperatura ambiente.
- Poseen densidades bajas, el helio es el más liviano de todos los gases nobles.
- Tienen baja solubilidad en agua, aunque el radón presenta una solubilidad algo mayor.
- El helio muestra una conductividad térmica alta, útil para aplicaciones criogénicas.
- Son no inflamables, lo que permite usarlos para crear atmósferas seguras en procesos industriales.
- A presión atmosférica, el helio no se solidifica, incluso a temperaturas extremadamente bajas.
Propiedades químicas
- Son muy poco reactivos debido a que tienen su capa de valencia completa, lo que les da estabilidad.
- Presentan altas energías de ionización, lo que hace difícil arrancarles un electrón.
- Poseen bajas afinidades electrónicas, por lo que casi nunca aceptan electrones adicionales.
- Forman compuestos solo en condiciones extremas, como con agentes oxidantes muy fuertes o bajo presiones elevadas.
- Los compuestos conocidos se dan sobre todo con xenón y criptón, mientras que el helio y el neón prácticamente no forman compuestos.
- No participan en reacciones redox en condiciones ordinarias por su estabilidad electrónica.
¿Cuáles son los usos de los gases nobles?
A pesar de ser poco reactivos, los gases nobles tienen una sorprendente variedad de aplicaciones en industrias, ciencia y tecnología. Su estabilidad, su comportamiento predecible y ciertas propiedades físicas únicas los hacen indispensables en numerosos campos.
- Helio: es probablemente el más utilizado. Su baja densidad lo convierte en el gas ideal para globos aerostáticos y de investigación. Su capacidad para alcanzar temperaturas extremadamente bajas también lo vuelve esencial para la refrigeración de imanes superconductores, como los que se usan en resonancias magnéticas. En metalurgia, ayuda a crear atmósferas inertes para evitar la oxidación.
- Neón: es conocido por los tubos luminosos, donde produce su característico resplandor rojizo. Además, se utiliza en sistemas de iluminación para señalización, en láseres y como refrigerante criogénico.
- Argón: es uno de los gases nobles más demandados por la industria. Se emplea en soldadura por arco para proteger el metal fundido del contacto con el oxígeno y el nitrógeno del aire. También se usa en bombillas incandescentes y en ventanas de doble acristalamiento para mejorar la eficiencia térmica.
- Criptón y xenón: se utilizan en lámparas de alta intensidad, como las de proyectores, faros de autos y flashes fotográficos. El xenón se aprovecha además en aplicaciones espaciales, muchos motores iónicos funcionan con este gas debido a su masa atómica elevada.
- Radón: aunque es radiactivo y peligroso, tuvo usos médicos en el pasado, especialmente en radioterapia. Hoy, su principal interés se relaciona con estudios geológicos y ambientales, ya que su presencia puede indicar fallas geológicas o problemas de ventilación en viviendas.

Preguntas frecuentes sobre gases nobles
¿Por qué los gases nobles no reaccionan químicamente?
La razón fundamental es su configuración electrónica estable. Al tener completa su capa de valencia, no necesitan ganar ni perder electrones. Esto los convierte en elementos que rara vez participan en reacciones químicas. Solo bajo condiciones extremas, como presiones muy altas o con agentes oxidantes muy potentes, pueden formar compuestos.
¿Cuál es el gas noble más abundante en la atmósfera?
El gas noble más abundante en la atmósfera terrestre es el argón, que representa aproximadamente el 0,93% del aire. El helio es mucho menos abundante, casi trazas, porque tiende a escapar al espacio. El neón, el criptón y el xenón están presentes en cantidades aún menores.
¿Cuál es el gas noble más pesado y cuál el más ligero?
El más ligero es el helio, lo que explica su uso en globos y aeronaves ligeras. El más pesado es el radón, que además es radiactivo. El xenón ocupa un lugar intermedio, pero es lo suficientemente pesado como para ser interesante en aplicaciones de propulsión espacial.
¿Qué diferencia hay entre un gas noble y un gas inerte?
Los términos suelen usarse como sinónimos, pero no significan exactamente lo mismo. Gas noble es un concepto químico que se refiere a los elementos del grupo 18. En cambio, gas inerte describe cualquier gas que no reacciona fácilmente. Por ejemplo, el nitrógeno suele comportarse como un gas inerte en muchas aplicaciones industriales, pero no es un gas noble.
¿Los gases nobles son tóxicos o peligrosos para la salud?
En general, los gases nobles no son tóxicos porque no reaccionan con los tejidos biológicos. Sin embargo, algunos pueden ser peligrosos en ciertos contextos. El helio, por ejemplo, puede causar asfixia si desplaza al oxígeno en espacios cerrados. El xenón, en altas concentraciones, produce efectos anestésicos. El radón sí representa un riesgo claro para la salud: su radiactividad se asocia con un mayor riesgo de cáncer de pulmón.
Si deseas leer más artículos parecidos a Gases nobles: qué son, cuáles son, propiedades y usos, te recomendamos que entres en nuestra categoría de Química.
- Gases Nobles. Elementos Químicos. Disponible en:https://elementosquimicos.eu/category/gases-nobles/
- Glossary: Noble Gases. European Comission. Disponible en: https://ec.europa.eu/health/opinions/en/energy-saving-lamps/glossary/mno/noble-gases.htm